Ацетилен хорошо растворим в воде или нет
Ацетилен
Характеристики и физические свойства ацетилена
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
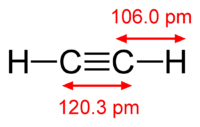
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
M(H-C(O)H) = 30 г/моль;
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Вычислим массу пропана (молярная масса 44 г/моль):
Тогда, общая масса смеси углеводородов составит:
Ацетилен
| Ацетилен | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Этин |
| Традиционные названия | Ацетилен |
| Химическая формула | C2H2 |
| Физические свойства | |
| Молярная масса | 26,038 [1] г/моль |
| Плотность | 0,001173 [1] г/см³ |
| Термические свойства | |
| Температура плавления | -80, 6 °C |
| Температура кипения | −83,8 °C |
| Энтальпия образования (ст. усл.) | 226,88 кДж/моль |
| Химические свойства | |
| pKa | 25 |
| Структура | |
| Гибридизация | sp |
| Классификация | |
| Рег. номер CAS | 74-86-2 |
| SMILES | C#C |
| Номер ООН | 1001 |
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 История
- 4 Способ производства
- 5 Применение
- 6 Безопасность
- 7 Примечания
- 8 Ссылки
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства


Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
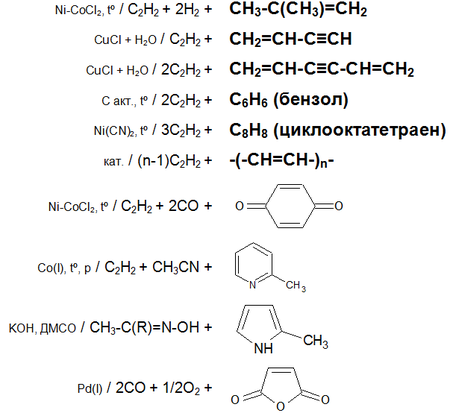
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
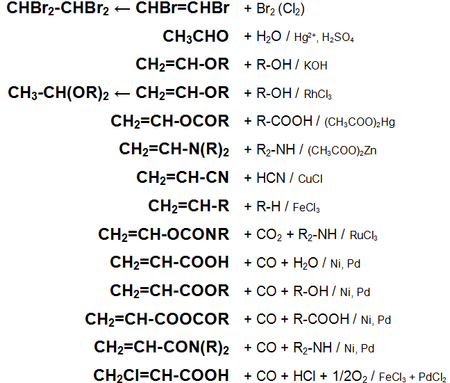
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение


- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Ацетилен
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С. Формула ацетилена говорит о том, что в его состав входят только углерод и водород.

Ацетилен в баллонах
Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.

Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.

Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными характеристиками получаемого газа и его формулой.
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Формула ацетилена

Строение молекулы ацетилена
Ацетилен имеет простую формулу — С2Н2. Относительно дешевый способ его получения путем перемешивания воды и карбида кальция сделал его самым применяемым газом для соединения металлов. Температура с которой горит смесь кислорода и ацетилена вынуждает выделяться твердые частицы углерода.
Ацетилен можно доставить к месту выполнения работ в специальных емкостях (газовых баллонах), а можно получить его непосредственно на рабочем месте используя для этого специально сконструированный реактор. Где происходит смешивание воды и карбида кальция.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм 3 /час, при правом 650-750 дм 3 /час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Использование ацетилена
Кроме сварки ацетилен применяют в следующих случаях:
- для получения яркого света в автономных источниках света (карбидная лампа);
- при изготовлении взрывчатых веществ, это уже упоминавшиеся ацетилениды;
- получения некоторых химических веществ, например, уксуса, спирта, полимеров и пр;
- кроме этого, ацетилен нашел свое применение и в ракетной технике, в качестве компонента топлива.
Стандарты
Производители ацетилена руководствуются при его получении требованиями ГОСТ 5457-75. В нем определены требования к газообразному и жидкому ацетилену.
Газ в баллоне
Для хранения и транспортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа.

Ацетилен в баллонах
На поверхности баллона должны быть выбиты следующие данные:
Товарный знак производителя, дата производства, параметры давления и некоторые другие, которые характеризуют это изделие.
На поверхность баллонов наносят краску белого цвета. Кроме этого, в обязательном порядке должны быть нанесена надпись АЦЕТИЛЕН. При этом высота шрифта не должна быть менее 6 см.
Баллон заполняют пористым наполнителем. Его задача более равномерное распределение газа внутри баллон, другая задача заключается в предохранении газа от распада.
Ацетилен
Ацетилен — газообразное вещество, состоящее из углерода и водорода с формулой C2H2 .
Свойства
Ацетилен представляет собой бесцветный газ с удельным весом 0,92. Когда ацетилен получают действием воды на карбид кальция, газ имеет очень сильный неприятный запах. Но после тщательной очистки от сернистого и фтористого водорода ацетилен издаёт лишь специфический «эфирный» аромат.
Ацетилен может быть сжижен действием холода или сжатием — при температуре 0° C и давлении 21,53 атмосферы он превращается в жидкость, при повышении температуры необходимое для ожижения давление повышается, при понижении снижается, пока при −82° C ацетилен не переходит в жидкое состояние при атмосферном давлении. Критическая точка газа — 37° C, при этой температуре для сжижения ацетилена требуется давление в 68 атмосфер.
Если позволить жидкому ацетилену быстро вытекать из баллона, он превращается в газ так быстро, что оставшаяся часть сильно остывает и, достигнув −90° C, застывает, образуя плотную, напоминающую снег массу.
Растворимость ацетилена
Ацетилен хорошо растворим в воде — при комнатной температуре и нормальном давлении она поглощает чуть более одного объёма газа. Этот раствор даёт пурпурно-красный осадок с медноаммиачной солью и белый — с нитратом серебра, эти осадки представляют собой ацетилениды металлов.
Растворимость ацетилена в различных жидкостях (по разным источникам) такова:
| 100 объёмов | Поглощают | Объёмы ацетилена |
| Солевой раствор | . | 5 |
| Вода | . | 110 |
| Спирт | . | 600 |
| Парафин | . | 150 |
| Дисульфид углерода | . | 100 |
| Сивушные масла | . | 100 |
| Бензол | . | 400 |
| Хлороформ | . | 400 |
| Уксусная кислота | . | 600 |
| Ацетон | . | 2500 |
Как видно из таблицы, лучше всего ацетилен поглощается ацетоном — 25 объёмов газа при 15° C и атмосферном давлении. При увеличении давления ацетон продолжает поглощать 25 объёмов ацетилена на каждую избыточную атмосферу.
Поскольку в своё время с ацетиленом связывались большие надежды, как с удобным топливом для транспорта, хорошая его растворимость в ацетоне казалась очень удобным способом повысить безопасность его хранения и транспортировки. Но проблема оказалась в том, что ацетон, поглощая ацетилен, немного увеличивался в объёме, следовательно, невозможно было полностью заполнить баллон ацетоном, а затем насытить его ацетиленом. Если же залить объём баллона ацетоном лишь частично, то пространство над жидкостью оказывалось заполненным ацетиленом под высоким давлением, что было так же опасно, как и обычный баллон со сжатым ацетиленом.
Но решение было найдено — сначала баллон заполняли пористой керамической массой, а затем пропитывали её определённым количество ацетона, таким образом, что каждый его объём мог поглотить десять объёмов ацетилена на каждую атмосферу давления. Таким образом, опасность взрыва была почти полностью устранена.
Ацетилен самовозгорается при контакте с хлором. Если кусочек карбида кальция бросить в водный раствор хлора, то пузыри газа, поднимающиеся на поверхность, будут самовоспламеняться. Струя ацетилена в атмосфере хлора горит красным пламенем, оставляя на стенках сосуда налёт чистого углерода в виде сажи. Хлор, пущенный в стоящий над водой стакан с ацетиленом, вызывает взрыв, сопровождающийся яркой вспышкой и выделением сажи.
Полимеризация ацетилена
Стекло небольшой колбы с ацетиленом, стоящей на свету, постепенно темнеет. Ацетилен по действием солнечного света подвергается полимеризации, при этом на стенках сосуда откладывается плёнка тяжёлых углеводородов.
При длительном стоянии ацетилена при низкой температуре в присутствии воды образуются гидраты.
Горение ацетилена
Ацетилен — одно из веществ, при образовании которых происходит поглощение тепла, и по этой причине такие реакции называются «эндотермическими», в противоположность тем соединениям, реакции образования которых вызывают выделение тепла — «экзотермическими». Такое эндотермические соединения почти всегда активно разлагаются с выделением накопленной энергии и это, без сомнения, связано со свойством ацетилена легко детонировать от нагрева.
Нагретый в присутствии воздуха до 480° C ацетилен воспламеняется и горит пламенем, вид которого зависит от соотношений компонентов горючей смеси. Если имеется избыток ацетилена, пламя сильно коптит, но если придать ему плоскую форму, начинает ярко светиться ярким белым светом. Имея точку воспламенения ниже точки бытового газа, ацетилен может быть зажжён раскалённым угольком, например, тлеющим концом сигареты.
Для полного сгорания смеси на один объём ацетилена требуется 12 объёмов воздуха, в таком случае продуктами сгорания являются углекислый газ и водяные пары. Если смесь богатая (недостаточно воздуха), при её горении образуются углерод (сажа), угарный газ, водород и водяные пары.
При смешивании с воздухом, как и любой другой горючий газ ацетилен образует взрывоопасные смеси, причем у ацетилена этот диапазон соотношений шире, чем у любого другого газа. Сравнительные соотношения эти следующие:
| Ацетилен | . | от 3% до 82% |
| Водород | . | от 5% до 72% |
| Угарный газ | . | от 13% до 75% |
| Этилен | . | от 4% до 22% |
| Метан | . | от 5% до 13% |
Получение ацетилена
Существует несколько методов, которыми можно получить ацетилен в небольших количествах. До начала промышленного производства карбида кальция, существовало несколько лабораторных способов получения ацетилена.
Первый — разложением этиленбромида, капельно добавляя его в кипящий спиртовой раствор гидроксида калия и последующей очисткой выделяющегося газа от паров этиленбромида пропусканием его через кипящий спиртовой раствор гидроксида калия во втором сосуде или нагретую натронную известь.
Второй — пропускание продуктов неполного сгорания газа бунзеновской горелки через аммиачный раствор хлорида меди. При этом образуется красный осадок ацетиленида меди, который промывают, и при разложении его под действием серной кислоты образуется ацетилен. Этот второй метод имеет тот недостаток, что при недостаточных усилиях по очистке газа, получаемого из ацетиленида меда он всегда загрязнён хлористыми производными ацетилена.
В 1836 году Эдмунд Дэви получил ацетилен из соединения, образовывавшегося при получении калия из тартрата калия и древесного угля — при определённых условиях на выходе получалось чёрное вещество, активно разлагавшееся водой с выделением ацетилена. Это вещество было изучено Берцелиусом, который показал, что это — карбид калия. Также он получил соответствующее соединение натрия, выделявшее тот же газ. В 1862 году Вёлер получил карбид кальция, а получение карбида кальция из извести и углерода, сплавляемых в электропечи, было почти одновременно открыто Вильсоном в Америке и Муассаном во Франции (при этом известь восстанавливается до кальция, который соединяется с избытком углерода, образуя карбид).
Производство карбида кальция
Дешёвое производство карбида кальция и лёгкое получение из него ацетилена немедленно придало газу коммерческую ценность.
При производстве карбида кальция в дуговой электропечи применяется известь и кокс как можно более высокой чистоты. Хорошая рабочая смесь этих материалов — 100 весовых извести на 68 весовых частей кокса. На каждый килограмм выхода карбида кальция идёт 1,8 кг рабочей смеси.
Существует два основных промышленных способа получения карбида кальция электродуговым способом — получением слитков и постепенным выпуском.
При первом методе (получение слитков карбида кальция) известь и кокс мелко размалывают и тщательно перемешивают в нужной пропорции. Электрод устанавливается в тигле, частично наполненным рабочей смесью, при возникновении дуги со дна тигля начинает постепенно образовываться слиток карбида кальция, причём угольный электрод постепенно поднимается для компенсации падения сопротивления укорачивающейся дуги, которая касается растущего слитка.
По мере роста слитка в тигель продолжают подсыпать рабочую смесь. Сам тигель изготовлен из металла и его объём значительно больше, чем объём получаемого слитка — таким образом масса нерасплавленной смеси защищает стенки тигля от высокой температуры дуги. Когда слиток достигает заданной величины, тигель вынимают из установке и заменяют его другим. Таким образом процесс изготовления карбида не является непрерывным, но смена тигля занимает всего две или три минуты и происходит каждые 10–15 часов.
Преимущество этого метода в том, что кокс и известь нагреваются только до точки реакции, и готовый карбид не «варится» после этого. Слиток почти полностью состоит из кристаллического карбида кальция, но поверхность его покрыта коркой из не полностью прореагировавших компонентов рабочей смеси. Так как это снижает выход ацетилена на единицу массы продукты, перед упаковкой в герметичную влагостойкую тару слитки механически очищают от этой корки.
Данные относительно выхода карбида на киловатт-час затраченной энергии несколько разнятся. Например, если «из печи» его указывают как 0,230 кг, то после чистки слитков, их дробления, сортировки и упаковки эта цифра снижается до 0,185 кг карбида кальция на киловатт-час электроэнергии.
При втором методе производства (постепенным выпуском расплавленного карбида) используется неподвижный тигель, футерованный графитом и электрод, чей размер почти совпадает с размером тигля. При этом сила тока, подаваемого на электрод, намного выше. Рабочая смесь, находящаяся в тигле, нагревается до полного её расплавления и сливается отдельными порциями через короткие промежутки времени. При этом процессе не остаётся непрореагировавших материалов и сам процесс технически проще, но сама установка — намного дороже.
Тем не менее, плавленый карбид кальция не так чист, как карбид в слитках, потому что в смесь для его получения приходится вводить излишек извести, которая действует как флюс. Следовательно, и объём выделяемого ацетилена у такого карбида меньше.
Свойства карбида кальция
Карбид кальция, полученный в дуговой печи — кристаллическое полуметаллическое вещество с удельным весом 2,22, играющее на изломе радужными цветами.
При хранении на сухом воздухе не изменяется, но малейшее количество влаги ведёт к постепенному выделению ацетилена, который обнаруживает себя характерным запахом. Карбид кальция не плавится при температурах менее 2000° C, но может быть сплавлен электрической дугой.
При нагревании до температуры в 245° C в потоке хлора начинает светиться, при этом образуются хлорид кальция и углерод, также его можно сжечь в кислороде при тёмно-красном калении — при этом образуется карбонат кальция. При тех же условиях карбид кальция начинает светиться в парах серы, с образованием сульфида кальция и выделением дисульфида углерода; пары фосфора также вступают в реакцию с ним при красном калении.
Действие воды на карбид кальция приводит к выделению ацетилена и гидрата кальция. Один килограмм чистого кристаллического карбида кальция при нормальной температуре выделяет 0,362 м 3 ацетилена, но карбид, доступный в продаже производит не более 0,32 м 3 ацетилена при хорошем генераторе, в других случаях тот же карбид может дать и не более чем 0,25 м 3 газа.
Чистота карбида полностью зависит от степени чистоты материалов, применявшихся при его производстве. Ацетилен, получаемый из карбида, практически всегда содержит примеси водорода, аммиака, сероводорода, фтористого водорода, гидрида кремния и азота, а иногда — следы угарного и углекислого газов. Образование попутного водорода вызывается небольшими количествами металлического кальция, образовавшегося при производстве, а иногда количество этого металла так велико, что выделяющийся газ на 20% состоит из водорода. Это происходит в тех случаях, когда при производстве материал слишком долго находился в контакте с дугой — при этом перегрев вызывает разложение некоторого количества карбида кальция и образование металлического кальция. Присутствие свободного водорода почти всегда сопровождается и наличием гидрида кремния, образовавшегося при объединении атомарного водорода с примесями кремния в карбиде. Наличие аммиака в ацетилене объясняются присутствием в карбиде примесей нитрида магния.
Сероводород, который неизбежно присутствует в коммерческих сортах карбида, образуется при разложении сульфида алюминия. Сульфид алюминия, сульфид цинка и сульфид кадмия — единственные вещества в составе рабочей смеси, которые могут выдержат температуру электрической дуги без разложения или испарения, а из них — только сульфид алюминия разлагается водой с выделением сероводорода. Обычно сернокислый алюминий присутствует в карбиде кальция в количествах не более 0,1%.
Генерация ацетилена из карбида кальция
Для образования ацетилена из карбида кальция и воды всё, что необходимо сделать — это обеспечить контакт этих веществ, который реагируют друг с другом с образованием извести и ацетилена, а при избытке воды известь превращается в гидрат кальция.
Разложение ацетилена водой может осуществляться как медленным приливанием воды к избытку карбида, так и внесением кусочков карбида в избыточное количество воды. Оба этих метода используются в различных аппаратах, причём скорость реакции может меняться в широких пределах или выделение газа может быть полностью остановлено.
Генераторы ацетилена
Классифицируя ацетиленовые генераторы, необходимо выделить несколько типов таких устройств. В одних вода входит в контакт с излишком карбида, присутствующим в начале работы, в других карбид вносится в воду, причём вода всегда присутствует в избытке.
Первый тип аппаратов можно подразделить далее — в некоторых из таких устройств уровень воды поднимается до контакта с карбидом, в некоторых вода капает на карбид, а в некоторых — ёмкость с карбидом кальция опускается в воду и извлекается, если поток газа становится чрезмерным.
Генераторы ацетилена конструируются так, чтобы либо выделение газа соответствовало его количеству, потребляемому горелкой, либо газ поступает в промежуточный ресивер.
Качества, которыми должен обладать хороший генератор ацетилена, таковы:
- Низкая температура генерации;
- Полное разложение карбида;
- Максимальное выделение газа;
- Низкое давление в каждой части аппарата;
- Лёгкая зарядка аппарата и его чистка;
- Полное удаление воздуха из генератора перед началом работы.
При действии воды на карбид выделяется большое количество тепла (1/12 от сжигания эквивалентного количества углерода). Интенсивность тепловыделения — функция от времени, необходимого на завершение реакции. Количество выделения тепла различается, в зависимости от устройства аппарата, и если в одних из них вода никогда не достигает точки кипения, в других карбид может нагреваться до красного каления, то есть более чем 800° C.
Нагрев аппарата для получения ацетилена — не только источник опасности, это ухудшает выход газа и его качество. Лучшими конструкциями считаются те, где уровень воды медленно поднимается в контакте с карбидом или те, где карбид вносится в избыток воды.
Ацетилено-кислородная горелка
Когда промышленности стали доступны большие объёмы ацетилена, немедленно были сделаны попытки сжигать его с кислородом в горелке по типу водородной. Однако обнаружилось, что при низком давлении газа конец горелки так разогревается, что часть ацетилена разлагается ещё до сгорания, а отверстие форсунки забивается нагаром и плотного углерода.
После переделки резака удалось получить его устойчивую работу, причём пламя автогена оказалось намного горячее пламени кислородно-водородной горелки. Кроме того, его восстанавливающее действие позволило использовать его для сварки стали и многих малых металлургических процессов.


