Ацетилен используется для сварки и резки металлов
АЦЕТИЛЕН
АЦЕТИЛЕН (этин) – углеводород состава С2Н2, содержащий тройную углерод-углеродную связь. Название этого соединения уже более ста лет знакомо не только химикам. С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (СаС2 + 2Н2О ® С2Н2 + Са(ОН)2), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени – от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О ® С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Он был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом. На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н ® С2Н2. (Сейчас ацетилом называют группировку СН3СО; она входит в состав солей уксусной кислоты – ацетатов, а также ацетона СН3СО–СН3, ацетальдегида СН3СО–Н, ацетилхлорида СН3СО–Cl и многих других соединений.)
Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами, а в 1867 сделал очень важное для химической теории открытие: показал, что из трех молекул ацетилена можно получить молекулу бензола: 3С2Н2 ® С6Н6.
Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С ® СаС2 + СО. В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3. Сейчас широко применяются методы получения ацетилена из природного газа – метана: электрокрекинг 2СН4 ® С2Н2 + 3Н2 (струю метана пропускают между электродами при температуре 1600° С и быстро охлаждают, чтобы предотвратить разложение ацетилена); термоокислительный крекинг (неполное окисление) 6СН4 + 4О2 ® С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О (в реакции используют теплоту частичного сгорания ацетилена).
Чистый ацетилен при охлаждении сжижается при –83,8° С, а при дальнейшем понижении температуры быстро затвердевает. Он умеренно растворим в воде (1150 мл в 1 л воды при 15° С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм). Термодинамически ацетилен неустойчив; он взрывается при нагревании до 500° С, а при обычной температуре – при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами – с кислородом (он окрашен в голубой цвет) и с ацетиленом (белого цвета). Газы из баллонов поступают в специальную горелку. Еще в 1895 году было обнаружено, что при сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3150° С) достигается при содержании ацетилена 45% по объему. В таком пламени очень быстро расплавляются даже толстые куски стали.
Химия ацетилена впервые была детально изучена в работах академика А.Е.Фаворского (1860–1945). Оказалось, что ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной. Ацетилен – реакционноспособное соединение, вступающее в многочисленные реакции. В 1881 М.Г.Кучеров открыл реакцию присоединения к ацетилену воды в присутствии катализатора – солей ртути, при этом образуется ацетальдегид: С2Н2 + Н2О ® СН3СНО. Из ацетальдегида далее получают уксусную кислоту, ацетон, спирт.
В 1949 немецкий химик В.Ю.Реппе открыл важную реакцию карбонилирования (присоединения СО) ацетилена в присутствии никелевого катализатора: С2Н2 + СО + Н2О ® СН2=СН–СООН. Образующаяся в этой реакции непредельная акриловая кислота используется для получения разнообразных полимеров – акрилатов (к ним относится и органическое стекло – полиметилметакрилат). А присоединение к ацетилену синильной кислоты дает другой важнейший продукт – нитрил акриловой кислоты (акрилонитрил): C2H2 + HCN ® CH2=CH–CN. Его полимеризацией получают очень важные полиакрилонитрильные полимеры, из которых делают искусственные волокна, пластики, каучуки.
Галогены и гидрогалогены (последние – в присутствии катализаторов) легко присоединяются к ацетилену с образованием сначала замещенных этилена, затем – этана, например: HCєCH + Cl2 ® ClCH=CHCl, ClCH=CHCl + Cl2 ® CHCl2–CHCl2; HCєCH + HCl ® CH2=CHCl, CH2=CHCl + HCl ® CH3–CHCl2 (последние две реакции идут по правилу Марковникова). Образующиеся хлорпроизводные широко используются в качестве полупродуктов для дальнейших синтезов, а также как растворители (например, в химчистке).
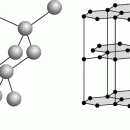
Ацетилен является слабой кислотой, в присутствии сильных оснований возможна ионизация этой связи с образованием ацетиленид-иона НєС–С – . Возможна ионизация и второй связи С–Н, поэтому при пропускании ацетилена в аммиачные растворы солей серебра и меди(I) образуются белый ацетиленид серебра C2Ag2 и красно-бурый ацетиленид меди C2Cu2. Оба соединения нерастворимы и выпадают в осадок; в сухом виде они они являются взрывчатыми веществами. Карбид кальция СаС2 также можно рассматривать как ацетиленид. Эти солеобразные соединения имеют ионную кристаллическую решетку, в узлах которой находятся катионы металла и анионы С2 2– .
В кислой среде в присутствии ионов Cu + ацетилен димеризуется с образованием винилацетилена НСєС–СН=СН2.
При его полимеризации образуются продукты, которые используются в производстве лакокрасочных материаловю – винил- и дидивинилацетиленовых лаков.
Приведенные примеры далеко не исчерпывают богатую химию ацетилена, из которого можно получить сотни разнообразных соединений. Недаром его годовое производство превышает 5 млн тонн. Из них примерно 70% используют для промышленного органического синтеза, а 30% – для сварки и резки металлов.
Получение и применение ацетилена
Прежде чем приступить к объяснению, где применяется ацетилен, давайте рассмотрим, как его получить.

Содержание
- Получение пиролизным способом
- Применение ацетилена
- Влияние примесей на качество сварного шва
- Применение в химической отрасли
- Уксусный альдегид
- Ацетон
- Хлористый винил
- Винилацетат
- Винилацетилен
Получение ацетилена производят двумя основными способами:
- из карбида кальция в результате реакции гидролиза
- из углеводородных продуктов, содержащихся в природных газах, нефти, газах от переработки угля и торфосланцев.
На данный момент способ получения ацетилена из карбида кальция используется редко, поскольку он довольно громоздкий, дорогой и требующий затрат большого количества электроэнергии.
Поэтому на смену ему пришел способ получения ацетилена из природного газа (метана) термоокислительным пиролизом метана с кислородом (так называемый пиролизный ацетилен).
Получение ацетилена пиролизным способом
Пиролизный ацетилен получают путем сжигания метана в смеси с кислородом в реакторах при температуре 1300-1500°C. В результате чего получается смесь, которая содержит:
- ацетилен – до 8%;
- водород – 54%;
- окись углерода – 25%;
- примеси – до 13%.
При помощи растворителя (диметилформамида) из нее извлекается ацетилен концентрации 99,0-99,2%. Оставшаяся часть пиролизных газов используется для производства аммиака и других продуктов.
Также ацетилен получают путем разложения жидких горючих (нефть, керосин) действием электродугового разряда, который называется электропиролизом.
Пиролизный и электропиролизный ацетилена по своим свойствам является идентичным ацетилену, получаемому из карбида кальция, но дешевле на 30-40%.
Применение ацетилена
Ацетилен применяется при всех процессах газопламенной обработки металлов (газовой сварке и газовой резки), благодаря высокой температуре пламени, достигнуть которой при использовании других горючих не удается.
Для пайки, резки, наплавки, газопламенной закалки, металлизации, газопрессовой сварки, сварки цветных металлов и сплавов с успехом применяются газы-заменители ацетилена:
- пропано-бутановые смеси
- городской газ
- природные газы
- водород
- пары бензина
- пары керосина
- МАФ
- и др.
По химическому составу все они, за исключением водорода, представляют собой или соединения, или смеси различных углеводородов.
Правильный выбор и использование газов-заменителей позволяет добиться высокого качества сварки и резки, а при газовой резке металлов малых толщин дает более высокую чистоту резки.
Газовая сварка возможна при условии, что температура пламени в два раза превышает температуру плавления свариваемого металла. Поэтому газы-заменители температура пламени которых ниже, чем у ацетилена применяют для сварки металлов с температурой плавления ниже, чем у сталей
Для газовой резки выбор горючего газа основывается на его теплотворной способности, но необходимо учитывать, что газ при сгорании в смеси с кислородом должен образовывать пламя с температурой не ниже 2000°C.
Влияние примесей в ацетилене на качество сварного шва
Давайте остановимся еще на некоторых особенностях применения ацетилена при газовой сварке – влияние примесей на качество сварного шва. Вредное влияние имеют следующие примеси:
- сероводород
- фосфористый водород
Вышеуказанные примеси обязательно удаляются из ацетилена, не только из-за влияния на качество сварного шва, но также из-за пагубного влияния на органы дыхания и зрения сварщика (см. статью Взрывоопасность, ядовитость и самовоспламенение ацетилена).
Сероводород при сгорании образовывает серную кислоту, которая при переходе в металл сварного шва вызывает красноломкость. Установлено, что наличие сероводорода до 0,007% не оказывает вредного влияния на прочность сварного шва.
Определить наличие сероводорода в ацетилене довольно легко, необходимо поднести фильтровальную бумагу, смоченную в растворе хлористой ртути под струю ацетилена. При наличии сероводорода – бумага побелеет.
Процесс очистки от сероводорода тоже довольно простой – необходимо ацетилен пропустить через воду, в результате чего сероводород растворится в воде.
Фосфористый водород при сгорании образовывает фосфорную кислоту, которая при переходе в металл сварного шва вызывает хладноломкость. Установлено, что наличие фосфористого водорода до 0,027% не оказывает вредного влияния на прочность сварного шва.
Для определения наличия фосфористого водорода необходимо кусок фильтровальной бумаги, смоченный в десятипроцентном растворе азотнокислого серебра поднести под струю ацетилена. При содержании 0,01% фосфористого водорода бумага принимает отчетливую светло- желтую окраску, при содержании более 0,02% – бумага темнеет.
Химическим путем очистка ацетилена от фосфористого водорода производится путем пропускания через особую очистительную массу – гератоль. Гератоль представляет собой массу желтого цвета, которая в результате взаимодействия с фосфористым водородом приобретает зеленый цвет.
Применение ацетилена в химической отрасли
Помимо газопламенной обработки ацетилен используют в области химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и т. п. Далее мы рассмотрим, как ацетилен используется для получения тех или иных химических соединений.
Уксусный альдегид
Продуктом присоединения воды к ацетилену является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Кучеровым в 1881 г. Реакция протекает по уравнению:
Реакция проводится пропусканием ацетилена через сернокислый раствор соли окиси ртути при температуре 70-80°C.
Применение этой реакции явилось началом промышленного синтеза органических веществ с применением ацетилена в качестве исходного продукта.
Ацетон
При пропускании смеси ацетилена и паров воды в соотношении примерно 1:10 при температуре 430-450°C над цинк-ванадиевым катализатором происходит образование ацетона по уравнению:
Указанный процесс нашел применение в промышленных масштабах.
Хлористый винил
При взаимодействии ацетилена с хлористым водородом при 200°C над катализатором, представляющим собой двухлористую ртуть, нанесенную на активированный уголь, образуется хлористый винил по уравнению:
Винилацетат
C уксусной кислотой также в присутствии ртутных солей ацетилен образует винилацетат:
Хлористый винил и винилацетат широко применяются при производстве пластмасс.
Винилацетилен
При пропускании ацетилена через насыщенный раствор однохлористой меди и хлористого аммония при температуре 50°C образуется винилацетилен.
Реакция протекает по уравнению:
CH ? CH + CH ? CH ? CH ? C-CH ? CH2
В результате присоединения хлороводорода к винилацетилену образуется хлоропрен, который способен к быстрой и самопроизвольной полимеризации с образованием каучука высоких технических качеств.
Химия винилацетилена нашла широкое теоретическое обобщение, что позволило значительно расширить область применения этого продукта.
При взаимодействии ацетилена со спиртами в щелочном растворе образуются простые виниловые эфиры.
Так, например, реакция между ацетиленом и этиловым спиртом протекает по уравнению:
Эта реакция была открыта А. Е. Фаворским в 1887 г.
Подводя итог всему вышенаписанному, мы установили, что ацетилен получают не только из карбида кальция, но также путем сжигания метана. При этом выяснили, что ацетилен применяют не только для газовой сварки и газовой резки, но и в химической отрасли для получения пластмасс, растворителей и т. д.
Ацетилен
| Ацетилен | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Этин |
| Традиционные названия | Ацетилен |
| Химическая формула | C2H2 |
| Физические свойства | |
| Молярная масса | 26,038 [1] г/моль |
| Плотность | 0,001173 [1] г/см³ |
| Термические свойства | |
| Температура плавления | -80, 6 °C |
| Температура кипения | −83,8 °C |
| Энтальпия образования (ст. усл.) | 226,88 кДж/моль |
| Химические свойства | |
| pKa | 25 |
| Структура | |
| Гибридизация | sp |
| Классификация | |
| Рег. номер CAS | 74-86-2 |
| SMILES | C#C |
| Номер ООН | 1001 |
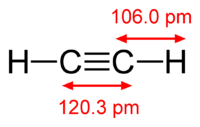
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 История
- 4 Способ производства
- 5 Применение
- 6 Безопасность
- 7 Примечания
- 8 Ссылки
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства


Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
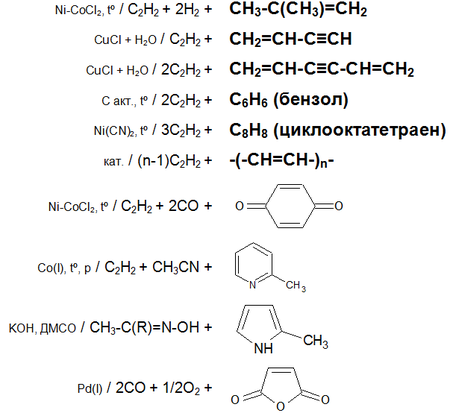
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
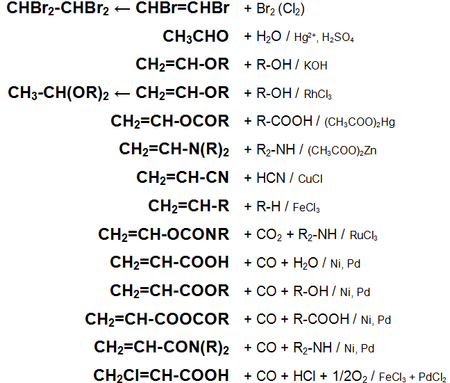
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение


- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Ацетилен – производство и характеристики

Название этого вещества связано со словом «уксус». Сегодня это единственный широко используемый в промышленности газ, горение и взрыв которого возможны в отсутствие кислорода или других окислителей. Сгорая в кислоте, он дает очень горячее пламя — до 3100°С.
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3.
Ацетилен сегодня: способы получения
Сейчас широко применяются методы получения ацетилена из природного газа – метана:
электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена); термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
Свойства ацетилена
В химически чистом виде ацетилен обладает слабым эфирным запахом. Технический ацетилен, благодаря наличию в нем примесей, в частности фосфористого водорода, имеет резкий специфический запах. Ацетилен легче воздуха. Газообразный ацетилен – бесцветный газ плотностью при 0 °С и 101,3 кПа (760 м рт. ст.) 1,173кг/м 3 . Молекулярная масса – 26,038.
Ацетилен способен растворяться во многих жидкостях. Его растворимость зависит от температуры: чем ниже температура жидкости, тем больше она способна «забрать» ацетилена. В практике производства растворенного ацетилена используют ацетон, который при температуре 15 °С растворяет до 23 объемов ацетилена.
Содержание фосфористого водорода в ацетилене должно быть строго ограничено, так как в момент образования ацетилена в присутствии воздуха при высокой температуре может произойти самовоспламенение.
Ацетилен — единственный широко используемый в промышленности газ, относящийся к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Еще в 1895 г. А.Л.Ле Шателье обнаружил, что ацетилен, сгорая в кислоте, дает очень горячее пламя (до 3150°С), поэтому его широко используют для сварки и резки тугоплавких металлов. Сегодня применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и т.д.). Однако преимущество ацетилена — в самой высокой температуре горения. В таком пламени очень быстро расплавляются даже толстые куски стали. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ — уксусного альдегида и уксусной кислоты, синтетических каучуков (изопренового и хлоропренового), поливинилхлорида и других полимеров.


