Аргон плавится при температуре
Свойства аргона Ar, плотность аргона и его теплопроводность

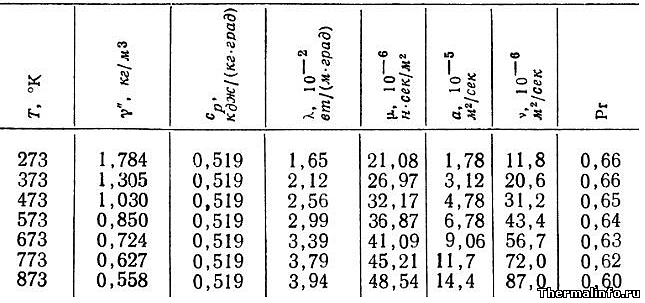
Свойства аргона (газ) при различных температурах
В таблице представлены теплофизические свойства аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Свойства аргона в таблице указаны при температуре от 0 до 600 °С.
Как видно по данным таблицы, с ростом температуры значения таких свойств аргона, как плотность и число Прандтля снижаются, а теплопроводность, вязкость и температуропроводность, напротив, растут.
Например, при температуре 273К (0°С) теплопроводность аргона составляет величину 0,0165 Вт/(м·град), а при температуре 600°С теплопроводность аргона увеличивается до значения 0,0394 Вт/(м·град).
В таблице приведены следующие свойства газа:
- плотность аргона, кг/м 3 ;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость, Па·с;
- температуропроводность, м 2 /с;
- кинематическая вязкость, м 2 /с;
- число Прандтля.
Примечание: Будьте внимательны! Теплопроводность газа в таблице указана в степени 10 2 . Не забудьте разделить на 100!
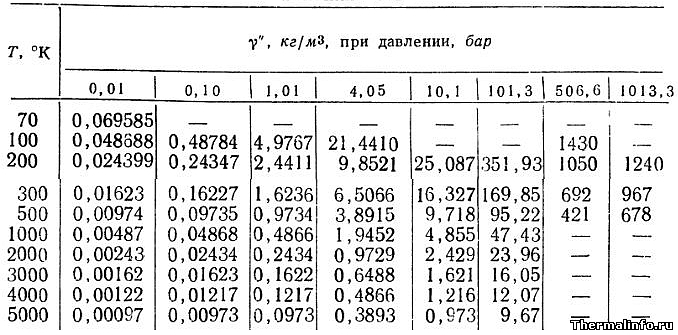
Плотность аргона при различных температурах и давлениях
В таблице указаны значения плотности аргона в газообразном состоянии при различных температурах и давлениях.
Плотность аргона в таблице указана при температуре от -203 до 4727 °С и давлении от 0,01 до 1013 атмосфер.
По данным таблицы при давлении 507 атмосфер и температуре -173 °С газообразный аргон имеет максимальную плотность 1430 кг/м 3 .
Минимум плотности аргона достигается при разряжении 0,01 атм. и температуре 4727 °С (плотность составляет 0,00097 кг/м 3 ).
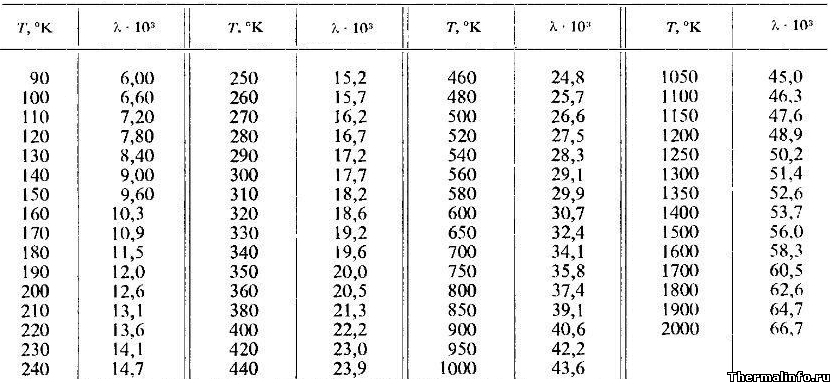
Теплопроводность аргона при различных температурах
В таблице указаны значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении в зависимости от температуры.
Теплопроводность в таблице указана при температуре от 90 до 2000 К.
Из таблицы следует, что теплопроводность аргона в газообразном состоянии при нормальном атмосферном давлении (1 бар) с ростом температуры также растет и достигает при 2000 К значения 0,0667 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность аргона указана в степени 10 3 . Не забудьте разделить на 1000!
Теплопроводность аргона в газообразном состоянии при высоких температурах
В таблице приведены значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении при высоких температурах.
Теплопроводность в таблице дана при температуре от 1500 до 5000 К (от 1227 до 4727 °С).
Из таблицы видно, что теплопроводность аргона при высоких температурах с ростом температуры также увеличивается и равна при 5000 К значению 0,131 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность указана в степени 10 3 . Не забудьте разделить на 1000!

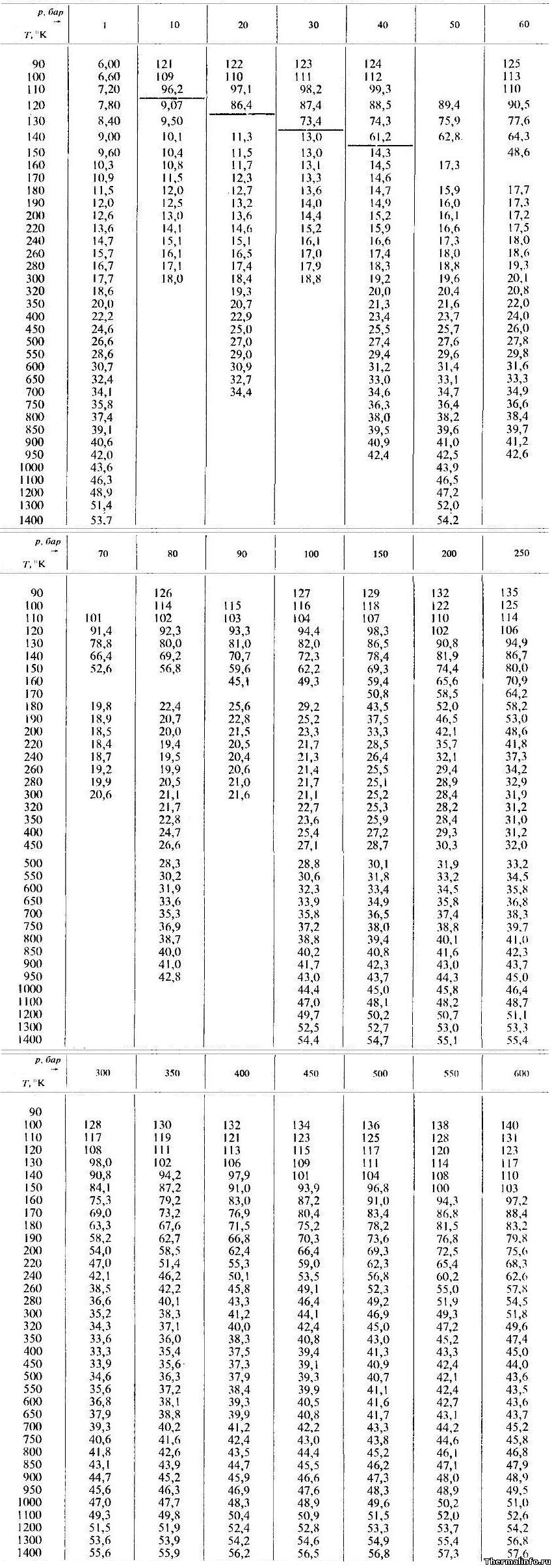
Теплопроводность аргона при различных температурах и давлениях
В таблице даны значения теплопроводности аргона в жидком и газообразном состояниях при различных температурах и давлениях.
Теплопроводность указана при температуре от 90 до 1400 К и давлении от 1 до 600 атмосфер.
По данным таблицы максимальная теплопроводность аргона достигается при давлении 600 бар и температуре 100 К (теплопроводность равна 0,14 Вт/(м·град)).
Примечание: Будьте внимательны! Теплопроводность указана в степени 10 3 . Не забудьте разделить на 1000!
Теплопроводность жидкого аргона на линии насыщения
В таблице представлены значения теплопроводности аргона в жидком состоянии на линии насыщения.
Теплопроводность аргона в таблице указана при температуре от 90 до 150 К.
Значение теплопроводности жидкого аргона на линии насыщения с повышением температуры снижается.
Примечание: Будьте внимательны! Теплопроводность в таблице указана в степени 10 3 . Не забудьте разделить на 1000!

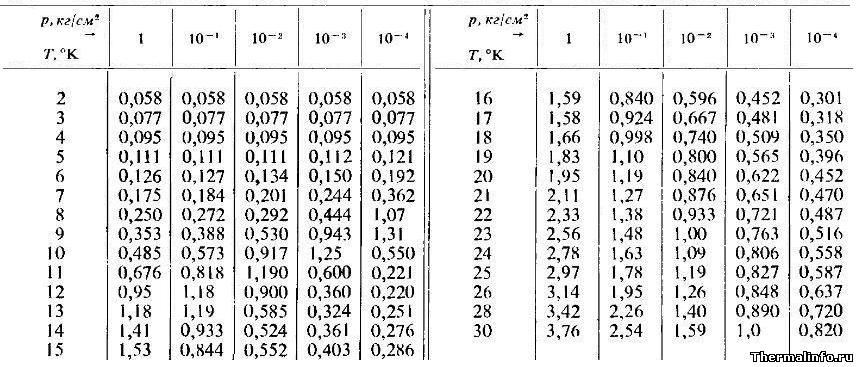
Теплопроводность аргона при низких температурах и давлениях
В таблице представлены значения теплопроводности аргона в ионизированном состоянии при сверхнизкой температуре и давлении (разряжении)
Теплопроводность в таблице дана в размерности ккал/(м·час·град) при температуре от 2 до 30 К и разряжении до 0,0004 атмосферы.
По данным таблицы видно, что максимальная теплопроводность ионизированного аргона равна 3,76 ккал/(м·час·град).
 Источники:
Источники:
1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей.
2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
Аргон – самый ленивый газ
Содержание
- История открытия
- Способы получения
- Применение
- Применение в сварке
- Вредность и опасность
- Хранение и транспортировка
- Характеристики аргона
- Коэффициенты перевода объема и массы Ar при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы Ar при Т=0°С и Р=0,1 МПа
- Аргон в баллоне
- Давление аргона в баллоне при различной температуре
На данный момент известны изотопы аргона с массовыми числами от 29 до 54, но в в земной атмосфере он представлен тремя стабильными изотопами:
- 40 Ar (изотопная распространённость 99,600 %)
- 36 Ar (изотопная распространённость 0,337 %)
- 38 Ar (изотопная распространённость 0,063 %)
История открытия aргона
Аргон был открыт Джоном Уильямом Стреттом (John Strutt) и Сэром Уильямом Рамзаем (Sir William Ramsay) при исследовании азота, полученного из воздуха химическим путем. Несовпадение плотности этого газа при различных способах получения натолкнуло этих ученых на идею о присутствии в воздухе какого-то тяжелого инертного газа, который и был выделен ими в 1894 г. и назван argon, что с греческого переводится как «ленивый», «медлительный», «неактивный».
Способы получения аргона
Аргон получают как побочный продукт, при производстве кислорода и азота из воздуха методом низкотемпературной ректификации (см. получение аргона)
Применение аргона
Наиболее часто аргон применяют:
- как защитный газ при сварке;
- как плёнкообразующий газ при плазменной сварке и резке;
- для вытеснения кислорода и влаги из упаковки при хранении пищевых продуктов, что увеличивает срок их хранения (пищевая добавка Е938);
- как газ для тушения огня в некоторых системах пожаротушения.
Применение аргона в сварке
Аргон применяют в качестве защитной среды при сварке активных и редких металлов (титана, циркония и ниобия) и сплавов на их основе, алюминиевых и магниевых сплавов, а также хромоникелевых коррозионностойких жаропрочных сплавов, легированных сталей различных марок.

Для сварки черных металлов аргон обычно используются в смеси с другими газами – кислородом, гелием, двуокисью углерода или водородом.
Аргон, являясь более тяжелым, чем воздух, своей струей лучше защищает металл при сварке в нижнем положении. Растекаясь по поверхности свариваемого изделия, он защищает достаточно длительно довольно широкую и протяженную зону как расплавленного, так и нагретого при сварке металла.
Низкий ионизационный потенциал аргона помогает получить превосходный профиль сварочного шва и сохранять хорошую и устойчивую дугу от начала до конца. В тоже время, низкий потенциал ионизации является причиной и низкого напряжения на дуге, что снижает тепловую мощность дуги. Для более подробной информации рекомендуем статью о свойствах сварочной дуги в инертных газах – аргоне и гелии.
Применение аргона позволяет повысить температуру сварочной дуги, что улучшает проплавление сварного шва, увеличивая производительность сварки в целом. При этом проплавление приобретает «кинжальную» форму, что дает возможность выполнять однопроходную сварку в щелевую разделку металла больших толщин. При сварке в среде аргона (как и иных инертных газов) минимизируется выгорание активных легирующих элементов, что позволяет использовать более дешевые сварочные проволоки.

При TIG сварке аргон служит защитой не только для сварочной ванны от вредного воздействия воздуха, а также инертной защитой конца электрода.
Для дуговой сварки в целом аргон применяется гораздо чаще, чем гелий, однако при сварке листового алюминия толщиной менее 6 мм аргон рекомендуют смешивать с гелием, чтобы обеспечить нужную теплопроводность. В некоторых случаях аргонно-гелиевые смеси используют для зажигания дуги, после чего сварка происходит в присутствии гелия. Этот метод применяется для сварки толстолистового алюминия вольфрамовым электродом при постоянном токе.
Вредность и опасность аргона
Аргон не оказывает опасного воздействия на окружающую среду, но относится к асфиксантам (удушающий газ). Поскольку газообразный аргон тяжелее воздуха он может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается содержание кислорода в воздухе, что вызывает кислородную недостаточность и удушье. Поэтому можно сделать вывод, что в больших количествах аргон вреден для организма человека.
Жидкий аргон – низкокипящая жидкость, которая может вызвать обморожение кожи и поражение слизистой оболочки глаз человека.
Хранение и транспортировка аргона
Газообразный и жидкий аргон поставляется по ГОСТ 10157. Хранят и транспортируют газообразный аргон в баллонах по ГОСТ 949 под давлением 15МПа.
Стальные баллоны должны соответствовать ГОСТ 949. Баллон окрашивается в серый цвет с зеленой полосой и зеленой надписью «АРГОН ЧИСТЫЙ».
Возможна транспортировка аргона в жидком виде в специальных цистернах или сосудах Дьюара с последующей его газификацией.

Характеристики аргона
Характеристики Ar представлены в таблицах ниже:
Аргон

| Аргон | |
|---|---|
| Инертный газ без цвета, вкуса и запаха | |
 |
(молярная масса)
(первый электрон)
Аргон — химический элемент 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VIII группы) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon ). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон — инертный одноатомный газ без цвета, вкуса и запаха.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространённость
- 2.1 Во Вселенной
- 2.2 Распространение в природе
- 3 Определение
- 4 Физические свойства
- 5 Химические свойства
- 6 Изотопы
- 7 Получение
- 8 Применение
- 9 Биологическая роль

История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались всё новые порции бурых оксидов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырёк газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил своё исследование и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго — 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошёл своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удалён кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений учёных не заметили составной части воздуха, да ещё и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчёркивало важнейшее свойство элемента — его химическую неактивность.
Распространённость
Во Вселенной
Содержание аргона в мировой материи мало и оценивается приблизительно в 0,02 % по массе.
Аргон (вместе с неоном) наблюдается на некоторых звёздах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.

Распространение в природе
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,288 % по массе, его запасы в атмосфере оцениваются в 4⋅10 14 т. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объёме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере — 4⋅10 −6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5⋅10 −5 — 9,7⋅10 −5 %. Его содержание в Мировом океане оценивается в 7,5⋅10 11 т, а в изверженных породах земной оболочки — 16,5⋅10 11 т.
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. Плотность при нормальных условиях составляет 1,7839 кг/м 3
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина, например, Ar·6H2O.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы

Аргон представлен в земной атмосфере тремя стабильными изотопами: 36 Ar (0,337 %), 38 Ar (0,063 %), 40 Ar (99,600 %). Почти вся масса тяжёлого изотопа 40 Ar возникла на Земле в результате распада радиоактивного изотопа калия 40 K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
19 40 K → 20 40 Ca + e − + ν¯e
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведёт к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40 Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36 Ar и 38 Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36 Ar и 38 Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40 Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9 °C (87,3 кельвина) аргон конденсируется, при −189,35 °C (83,8 Кельвина) — кристаллизуется.
Ввиду близости температур кипения аргона и кислорода (90 K) разделение этих фракций ректификационным способом затруднительно. Аргон считается посторонней примесью, допускаемой только в техническом кислороде чистотой 96 %.
Применение

Ниже перечислены области применения аргона:
- в аргоновых лазерах;
- внутри ламп накаливания и при заполнении внутреннего пространства стеклопакетов;
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов (например, титана), так и неметаллов;
- в качестве плазмаобразователя в плазматронах при сварке и резке;
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа;
- в качестве огнетушащего вещества в газовых установках пожаротушения;
- в медицине во время операций для очистки воздуха и разрезов, так как аргон не образует химических соединений при комнатной температуре;
- в качестве составной части атмосферы эксперимента «Марс-500» с целью снижения уровня кислорода для предотвращения пожара на борту космического корабля при путешествии на Марс;
- из-за низкой теплопроводности аргон применяется в дайвинге для поддува сухих гидрокостюмов, однако есть ряд недостатков, например, высокая цена газа (кроме этого, нужна отдельная система для аргона);
- в химическом синтезе для создания инертной атмосферы при работе с нестабильными на воздухе соединениями.
- в металопластиковых окнах, для сохранения температуры в доме.
Биологическая роль
Аргон не играет никакой заметной биологической роли.
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа. В 2014 году WADA признала аргон допингом.
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
Аргон
Аргон (обозначается как Ar) — наиболее часто встречающийся в воздухе инертный газ. Он отличается полной химической инертностью. Это свойство позволяет широко применять газ в таких областях, как сварка, упаковка, производство материалов высокой чистоты, а также для тушения пожаров.

Инертный газ аргон
История открытия
Предыстория открытия Ar началась в 1785 году. Выдающийся ученый и естествоиспытатель из Великобритании Генри Кэвендиш исследовал состав воздуха. Он подвергал азот окислению и взвешивал получившиеся окислы. По окончании опыта в сосуде оставался газ. Кэвендиш определил его объем в 0,8% от начального объема воздуха.
Состав этого газа ученый определить не смог. Спустя столетие к проблеме вернулись сэры Джон Рэлей и Уильям Рэмзи. В ходе проведенных опытов они обнаружили, что азот, выделенный из воздуха, имеет большую плотность, нежели азот, получаемый в ходе реакции разложения нитрита аммония.
в 1884 году им удалось выделить из воздуха некий газ, более плотный, чем азот. Это вещество имело одноатомную молекулярную структуру и было крайне инертным — т.е. не реагировало с другими веществами.
На заседании Королевского Общества новому газу было присвоено название «аргон», что в переводе с древнегреческого значило «спокойный, ленивый»
Аргон в природе
Ввиду практически полной инертности Ar представлен в естественной среде исключительно в несвязанном виде. Его процентная доля в различных частях Земли равна приблизительно:
- земная кора — 0,00012%;
- морская вода — 0,00045%;
- атмосфера — 0,926%.
Доля Ar в воздухе выше, чем суммарная доля всех остальных инертных газов. Основным источником для его добычи служит наша атмосфера.

Содержание газов в атмосфере
В коре Земли аргон содержится также в виде радиоактивного изотопа Аргон-40 и появляется в ходе реакции распада изотопов Калия.
Современная наука вместе с остальными инертными газообразными элементами относит Ar к VIII группе периодической системы.
Как добывают аргон
Благодаря значительному с промышленной точки зрения содержанию аргона в воздухе его получают в качестве дополнительного продукта криогенной ректификации O2 и N2.
Технология основана на том факте, что температура кипения (или сжижения) Ar лежит между температурами N2 и O2.
Перед началом процесса воздух подвергается тщательной очистке от пыли в многоступенчатых фильтрах, осушается от водяных паров, а далее мощными компрессорами сжимается до тех пор, пока не перейдет в жидкое состояние. Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.

Установка для добычи аргона
Первым испаряется азот при -195 °С, его пары собираются на соответствующей тарелке ректификатора и отводятся в отдельный резервуар. Следующим по высоте (и при температуре кипения -185 °С) отбирается аргонная фракция, содержащая 12% Ar, менее полпроцента азота и кислород. Она подается в следующую ректификационную колонну, в которой процентная доля Ar доводится до 85, оставшееся приходится на кислород со следами азота. Такое вещество называется сырым аргоном, исходным материалом для получения очищенного газа.
В промышленности применяется несколько методов очистки сырого аргона от примесей.
Водород, добавляемый в состав сырья, окисляется на катализаторе и нагреве до 500 °С, таким образом, из состава смеси выводится кислород. Образовавшийся на катализаторе водяной пары удаляют при посредстве влагоотделителя. Газ после этого осушают. Аргон с оставшимся в нем азотом вновь ректифицируют.
Применяются и альтернативные методы получения Ar. Во время синтеза аммиака из азота и водорода в химических реакторах Ar получают как сопутствующий продукт производства. Технологический компонент это синтеза — продувочный газ — содержит до 20% Ar. Из этого газа и извлекают самый спокойный элемент. Стоимость производства, складывающаяся в основном из затрат на охлаждение и нагрев компонентов, делится между аммиаком и аргоном, и получается существенно ниже.
Качество газа, получаемого любым методом, определяется технологией очистки его от небольших количеств остаточного N2, O2, водяных паров и H2.

Аппарат, получающий ионные пучки аргона
Общая характеристика Ar
Ar входит в группу инертных газов. Заряд его ядра — 18, под таким же номером элемент располагается в таблице Менделеева.
Из всех участников VIIIA группы он является наиболее часто встречающимся в природе. Объемная доля Ar в атмосфере -0,93%, массовая доля составляет 1,28%.Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Весьма плохо растворим водой, чуть большая растворимость наблюдается при взаимодействии с органическими растворителям.
Виды аргона
Говоря о видах, или сортах Ar, надо понимать, что это одно и то же химическое вещество. Виды различаются по степени очистки от примесей.
- Высший сорт. Содержание Ar не менее 99,99% . Этот сорт особо высокой чистоты применяется для ответственных сварочных работ, таких, как сварка материалов, химически активных в нагретом состоянии: некоторые цветные сплавы, прежде всего титановые, нержавеющая сталь и др. Используется также для сварки высоконагруженных изделий из конструкционной стали.
- Первый сорт. Содержание Ar не менее 99,98%, Применяется при сварке сплавов на основе алюминия с другими металлами и сплавами, для менее активных цветных металлов.
- Второй сорт. Содержание Ar не менее 99,95%. Используется при сваривании деталей из жаростойких стальных сплавов, алюминия и конструкционных сталей. Применение чистого Ar в этих случаях нежелательно, поскольку приводит к повышенной пористости материала шва и не позволяет защитить сварочную ванну от повышенной влажности и других загрязнений. Во избежание возникновения такого дефекта в состав смеси защитных газов добавляют углекислый газ и кислород, связывающие выделяющийся при сварке водород и другие примеси. Образующиеся в ходе этих реакций шлаки всплывают на поверхность сварочной ванны и после застывания удаляются вместе с окалиной.
Физические и химические свойства
Свойства аргона типичны для члена VIII группы.
При обычной температуре Ar пребывает в газообразном состоянии. Молекула включает в себя единственный атома, химическая формула весьма простая: Ar. Температура кипения весьма низка : -185,8 °С при атмосферном уровне давления.
Растворимость в воде низкая — всего 3,29 мл на 100 мл жидкости
Плотность аргона при нормальных условиях составляет 1,78 кг/м 3 . Молярная теплоемкость газа- 20,7 Дж/Кмоль.

Характеристики аргона и других инертных газов
Газ практически полностью инертен. На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
Электроотрицательность по шкале Полинга равна 4,3.
Как степень окисления, так и электродный потенциал имеют нулевое значение, что характерно для инертного газа.
Ионный радиус составляет 154, радиус ковалентности — 106 Пм. Ионизационный порог- 1519 кдж/моль
Атомная и молекулярная масса
Такие важные параметры, как атомная и молекулярная массы, показывают, насколько масса молекулы вещества и масса его атома соответственно превышают значение, равное одной двенадцатой доле массы атома водорода.
Ввиду того, что молекула Ar состоит из единственного атома, молекулярная и атомная масса аргона идентичны и составляют 39,984.

Структура аргона и его свойства
Изотопы
В природных условиях Ar встречается в качестве трех устойчивых изотопов
- 36 Ar– процентная доля этого изотопа составляет 0,337% в ядре 18 протонов и 18 нейтронов;
- 38 Ar- его доля всего 0,063%, в ядре 18 протонов и 20 нейтронов;
- 40 Ar – наиболее распространен, его доля составляет 99,6%, в ядре так же 18 протонов, но уже 22 нейтрона.
Искусственным путем удавалось получать изотопы с массовым индексом от 32 до 55, наиболее стабильным из них оказался 39 Ar, период полураспада которого составляет 268 лет.
Большая процентная доля 40 Ar среди изотопов, встречающихся в природе, вызвана постоянным образованием его в ходе реакции распада изотопа калий-40. На 1000 кг калия в ходе таких реакций за год образуется не более 3100 атомов 40 Ar. Но, поскольку эти реакции идут постоянно в течение сотен миллионов лет, изотоп накопился в природе в существенных объемах.
Доминирование тяжелого изотопа в природе обуславливает тот факт, что атомный вес Ar превышает атомный вес калия, находящегося в таблице следом за ним. При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
Как и другие инертные газы (такие, как He и Ne), Ar подвержен ионизации. При возбуждении атомов и сообщении им высоких энергий возникают молекулярные ионы Ar2 + .
Молекула и атом
Для инертных газов эти понятия идентичны, поскольку эти элементы не желают вступать в химическую связь даже с себе подобными. Молекула включает в себя один атом, химическая формула газа не отличается от обозначения элемента: Ar.
Молярная масса
Молярная масса аргона составляет 39,95 г/моль.
Существуют несколько методов ее вычисления:
- С применением относительной атомной массы M и коэффициента пропорциональности к, выражающего соотношение между относительной массой и молярной. Этот коэффициент является универсальной константой и равен для всех элементов. Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.
- С использованием молярного объема. Потребуется найти объем, занимаемый при обычных условиях некоторой массой газа, далее рассчитать массу 22,4 литров вещества при таких же условиях.
- С применением уравнения Менделеева-Клапейрона, моделирующего идеальный газ.
проведя преобразования, получим выражение для молярной массы:
- p – давление в паскалях,
- V –объем в кубометрах
- m – масса в граммах,
- Т — температура в Кельвинах,
- R – константа, значение которой 8,314 Дж/(моль×К).
Область применения
Шире всего аргон применяется при сварочных работах. Он используется для создания защитной атмосферы вокруг сварочной ванны, вытесняя из рабочей зоны O2 и N2, содержащиеся в атмосфере. Особенно важно это для сварки цветных металлов, многие из которых, к примеру, Ti, отличаются высокой химической активностью в нагретом состоянии. Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Также широко применяется при монтаже высоконагруженных строительных конструкций, таких, как каркасы высотных зданий, фермы мостов и многих других. Здесь его применение обеспечивает высокое качество, однородность и долговечность ответственных соединений. В строительной индустрии аргонная сварка доминирует среди других методов.
Не менее широко применяется аргонная сварка в машиностроении, прежде всего химическом и пищевом. Швы получаются долговечные и надежные, даже в условиях воздействия агрессивных сред.
Нефтяная и газовая отрасли также применяют аргонная сварку при монтаже трубопроводов, газоперекачивающих станций и нефтеперегонных комбинатов.
Используется метод также в атомной промышленности, в транспортном машиностроении и в аэрокосмической отрасли.
В домохозяйствах аргонная сварка распространена не так широко. Это объясняется:
- высокой стоимостью оборудования и расходных материалов;
- необходимостью достаточной квалификации сварщика;
- меньшими нагрузками, испытываемыми домашними конструкциями;
- более низкими требованиями к прочности и долговечности сварных соединений.
Если в домохозяйстве возникает эпизодическая потребность в таких сварочных работах, то дешевле, быстрее и надежнее пригласить сварщика-специалиста.
Характерным свойством Ar является его более высокая плотность по сравнению с воздухом. Поэтому максимальная эффективность аргонной сварки достигается при нижнем сварочном положении. В этом случае инертный раз растекается по поверхности детали и образует защитное облако значительной протяженности, позволяя вести сварку, как большими токами, так и на большой скорости. При сварке в наклонном и верхнем положении приходится учитывать «проваливание» аргона сквозь воздух. Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Поскольку потенциал ионизации Ar невысок, его использование обеспечивает идеальные геометрических характеристик сварочного шва, прежде всего, профиля. Возбужденная электродуга в аргоновой атмосфере также отличается высокой стабильностью своих параметров. С другой стороны, низкое значение потенциала ионизации обуславливает и более низкое напряжение розжига и поддержания дуги. Это сокращает ее тепловыделение и усложняет провар толстых листов металла.
Более высокая температура дуги в аргоновой атмосфере существенно повышает проплав сварочного шва. Это позволяет проводить сварку за один проход при условии точного соблюдения параметров зазора между заготовками.
В случае применения TIG-метода сварочных работ аргоновая атмосфера защищает от коррозионного влияния не только зону сварки, но и окончание неплавкого электрода.
В ряде специфических случаев в состав защитной газовой смеси добавляют гелий.
Кроме применения при сварочных работах, аргон используется:
- Как плазмоообразующее веществона установках плазменного раскроя металла.
- Для создания инертной среды в упаковках пищевых продуктов. Он вытесняет из пакетов и контейнеров кислород воздуха и водяные пары, пагубно влияющие на срок годности продуктов. Продукты в защитной атмосфере хранятся в несколько раз дольше, чем в обычной упаковке. Применяется этот метод и для упаковки медицинских изделий и препаратов, позволяя сохранить их в должной стерильности и химической чистоте.
- В качестве активного агента в противопожарных установках. Аргон вытесняет кислород (или другой газ) из очага горения, прекращая его.
- Для создания защитной среды в технологических установках при обработке полупроводниковых устройств, создании микросхем и других электронных компонентов или материалов высоких степеней чистоты.
- Наполнитель электроламп.
- В рекламных люминесцентных трубках.
Зависимость давления аргона в баллоне от температуры
По мере нагрева давление газообразного вещества в замкнутом объеме повышается. В таблице приведены примерные значения давления в баллоне в зависимости от температуры окружающего воздуха.
| T, °C | P, Мегапаскаль |
| -40 | 10,45 |
| -30 | 11,33 |
| -20 | 12,21 |
| -10 | 12,92 |
| 13,74 | |
| +10 | 14,62 |
| +20 | 15,33 |
| +30 | 16,03 |
Следует учитывать, что баллонное давление изменяется не мгновенно, а по мере его прогрева или охлаждения.
Техника безопасности при работе с аргоном
Сам по себе не являясь ядовитым, аргон при неправильном использовании может нанести серьезный вред здоровью или даже создать угрозу жизни.
Аргон замещает кислород воздуха и создает смесь, непригодную для дыхания. Человек может пострадать или даже погибнуть от удушья. Сжиженный аргон имеет очень низкую температуру и при контакте с незащищенной кожей приводит к тяжелым обморожениям.

Газоразрядная трубка с аргоном
Во избежание неприятных последствий при работе с газом следует неукоснительно соблюдать следующие правила:
- При работе в атмосфере аргона обязательно использовать изолирующий противогаз.
- При работе на полуавтоматах с подачей аргона обеспечить вентиляцию рабочей зоны.
- Использовать газоанализатор, содержание кислорода в воздухе должно быть не ниже 19%.
- Спецодежда должна полностью закрывать коду, быть чистой и целой.
Перед началом работы также следует осмотреть баллоны, шланги и запорную арматуру на предмет отсутствия механических повреждений и утечек газа.


